Chapter 2. Target Product Profile(TPP)의 설정의 중요성
최봉근
0
655
2021.08.13 16:04
<첨부 파일 (PDF)> 참조
Chapter 2. Target Product Profile (TPP) 설정의 중요성
1. 서론
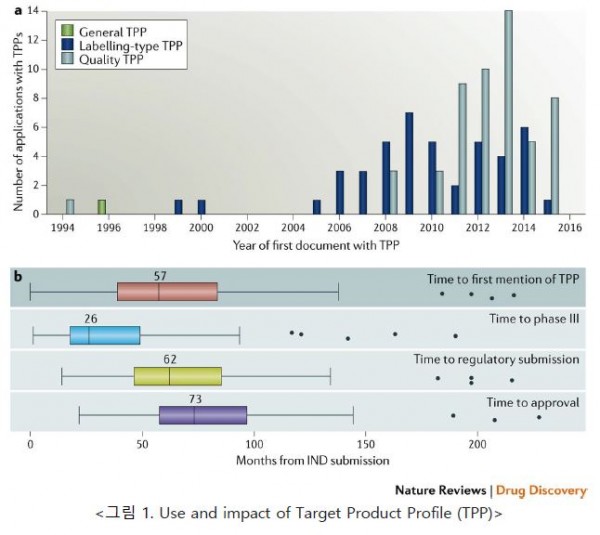
의약품 개발에 있어서 Target Product Profile (TPP, 목표 제품 특성)은 연구개발 기관 안팎에서 이해 당사자들 간의 소통 뿐 만이 아니라, 규제 기관 (정부 인허가)과의 소통을 원활히 하기 위한 수단 역할을 담당하고 있다 [그림 1]. 즉, 연구기관 안팎에서는 TPP에 기재된 연구개발의 최종 목표점을 이해 당사자들 모두가 공유하면서 연구 방향성을 제시하게 되고, 규제 기관과는 최종 시장에 출시하는 제품의 라벨을 정하기 위한 일련의 연구개발 계획과 과정을 피드백 하고 있다는 점이다 <그림 1>. TPP 상에는 제품 사양, 작용기전, 안전성, 효능, 체내동태, 투여 경로 등과 관련된 항목들이 있으며, 세부적으로는 제품의 임상 적응증과 사용에 관한 여러 사항들이 포함되어 있는 것을 볼 수 있다.
<그림 1. Use and impact of Target Product Profile (TPP)>
특히, 국내의 많은 신약 프로젝트에서는 중개연구 (Translational Research) 차원에서 연구개발 후보물질에 대한 Target Product (/Candidate) Profiles 설정을 중요시하고 중점 관리하고 있는 실정이며, 더 나가서는 선도물질 (Lead Compound)에 대한 Target Product (/Lead) Profile까지도 설정하는 사례가 있다.
이와 같이, 의약품의 연구개발에 있어서 이해 당사자들 간에 중요한 소통 수단 역할을 담당하는 최종 목표 제품 특성 (Target Product/Clinical Profiles, TPP)과 목표 후보물질 특성 (Target Product/Candidate Profile)의 설정 방법과 중요성에 대해서 신약 연구개발에서 각기 사례를 들어서 기술해 보기로 한다.
2. 본론
의약품 연구개발 신규 프로젝트 발굴 및 선정 시점에서부터, 최종 제품에 대한 Target Product (/Clinical) Profile (TPP, 목표 제품 특성)과 개발 후보물질에 대한 Target Product (/Candidate) Profile 설정에 대해서 고려하는 것이 필요하다고 본다. 즉, 연구개발 기관에서 개발하고자 하는 최종 목표 제품이 무엇인지를 구체화시킬 필요가 있으며, 이러한 목표 달성을 위해서는 어느 정도의 수준과 특성을 보유한 후보물질이 요구되며, 이 후보물질을 가지고서 어떠한 방법과 전략으로 개발할 것인지에 대한 계획이 필요한 것이다. 물론, 신규 프로젝트 초기에 설정한 TPP는 연구개발 과정에서 시장 상황과 경쟁력 등을 반영하여 지속적으로 업데이트 할 필요가 있다. 최종 목표 제품의 TPP 설정을 위해서는 의학적 수요, (잠재적) 경쟁 제품, 제품 종류, 마켓 포지셔닝, 작용기전, 효능과 안전성, 임상 적응증과 사용, 투여 경로 등에 대한 고려가 필요하고, 이들 TPP 항목들의 상당부분은 종국적으로 규제 기관의 인허가를 득하고 시장에 출시되는 제품 라벨 상에 서지 사항이 될 것이다.
우선, 연구 초기에 프로젝트 리더 (Project Leader, PL) 관점에서 파킨슨 (Parkinson’s Disease) 치료제 개발을 목표로 Target Product (/Clinical) Profiles (TPP, 목표 제품 특성)을 설정했던 사례를 소개해 본다 <표 1>.
1. 제품 사양 (Product Descriptions) 항목은 New Chemical Entity (NCE)로서 신경보호 소분자 물질이며 작용 기전은 Anti-apoptosis로 표기되었다 (작용점 생략).
2. 적응증 (Indications) 항목은 본 제품의 주요 치료 대상 환자군에 대해서 정의했고, 여기에는 현재 임상에서 1차 치료제로 사용되고 있는 DOPA 약제에 대한 사용 조건을 포함하고 있다.
3. 유효성 (Efficacy) 항목에는 단독 또는 DOPA 약제와의 병용 투여를 통해서 개발 제품이 달성시키고자 하는 파킨슨 질환 환자들의 치료 수준과 목표에 대한 기대 효능을 기술하고 있다.
4. 안전성 (Safety) 항목에서는 개발하고자 하는 의약품이 파킨슨 (Parkinson’s Disease) 치료제인 관계로, 특히 중추신경계 (CNS) 약물에서 빈번하면서도 심각하게 간주되는 부작용에 관한 것과 DOPA 약제와의 병용 투여를 감안하여 이들간에 약물 상호 작용에 대한 우려를 불식시키고자 하고 있다.
5. 투여 (Dosage) 항목에서는 복약 편의성에 따른 시장매력도를 감안하여 투여 경로 (경구)와 투여 간격 (1회/1일)을 제시하고 있다.
이와 같이 TPP를 설정함으로써, 최종 TPP 항목 1~5를 충족시키기 위해서는 중개연구 (Translational Research)와 개발 측면에서 후보물질의 Target Product (/Candidate) Profile은 어떻게 설정되어야 하는지를 알 수 있게 될 것이다.
<표 1. 파킨슨 치료제 Target Product (/Clinical) Profile (TPP) 사례>
앞에서 국내의 많은 신약 연구개발 프로젝트에서는 개발 후보물질에 대해서 Target Product (/Candidate) Profile을 설정하고 중점 관리하고 있다고 언급한 바, 이는 그동안 연구개발 기관 대부분의 의약품 연구개발 프로젝트, 특히 많은 신약 프로젝트들이 탐색연구 과정에 있으며 이 과정을 죽음의 계곡 (Death Valley)으로 보는 시각에서 중개 연구 (Translational Research)를 중요시 하기 때문인 것으로 본다. 따라서 다음 순서에서는 연구개발 후보물질들을 대상으로 Target Product (/Candidate) Profile이 설정된 사례들을 살펴보기로 하자.
첫 번째로 신약 탐색연구 과정에서 프로젝트 리더 (Project Leader, PL) 관점에서 진통제 (Pain) 개발을 목표로 하고 있는 후보물질을 대상으로 Target Product (/Candidate) Profile로 설정했던 사례를 소개해 본다 <표 2>.
물리화학적 성질 (Physicochemical property)은 약물성 (Drug-likeness)에 해당하는 항목으로서 치료적 수요 (Therapeutic Needs)에 기반하여 목표로 하는 의약품의 제형이나 투여 경로에 따라서 적합한 기준을 설정하고 있다. 여기서는 소분자 화합물이면서 경구 투여를 목표로 하므로, 통상적으로 이들 약물에 적용되는 적절한 범주의 지질도 (cLogP)와 물에 대한 일정 이상의 용해도를 감안하여 기준을 설정한 것을 볼 수 있다.
작용 기전 (Mode of Action, MoA) 항목은 임상적 유효성 (Efficacy)과 안전성 (Safety)을 예측하는 자료로 매우 중요하게 활용된다. 여기서는 Nav1.7 이온채널 타겟에 대하여 정상 대비 질환 통증 상태에만 작용하도록 하기 위해서 State & Use dependency 억제 패턴을 가지는 작용 기전을 지향하고 있다. 이는 경쟁물질 CNV1014802가 삼차신경통 임상 2상에서 약효를 입증한 바 있고, CNV1014802는 State & Use dependency를 가지기 때문에 부작용 (Side effects)가 없는 것으로 보고하고 있고, 글로벌 제약사에서 개발중인 Nav1.7 blockers는 모두 State & Use dependency 물질임을 감안하고 있다.
<표 2. 진통제 후보물질 Target Product (/Candidate) Profile (TPP) 사례>
효능 (Efficacy) 항목에서 ① In vitro는 주로 활성 (Activity)과 선택성 (Selectivity)에 관한 것으로서, 경쟁물질 CNV1014802는 Nav1.7 IC50가 1~5uM수준이며 subtype selectivity가 10배 이하 임을 감안하였고, 특히 Nav1.5는 Cardiac muscle, Nav1.1, 1.2, 1.3은 중추신경계 (CNS)에 많이 분포하고 있으며, 현재 임상에서 사용되는 신경병성 통증 약물들 (Lamotrigine, Carbamazepine등)은 Subtypes selectivity가 없기 때문에 Dizziness, Mental disorder 등의 부작용이 발생한다는 점을 반영하고 있다. ② Ex vivo는 Human DRG에서의 IC50과 Action potential 100% block@1uM을 정하고 있는데, 이는 Human DRG에서의 우수한 활성을 후보물질의 특장점으로 제시하여 임상 연계 (translation) 가능성 높이고자 함이다. ③ In vivo는 Safety margin을 고려하여 ED50을 산정하고 있다. 시험 동물의 체표 면적 차이 (전환 비율, Conversion Factor)로 계산하였을 때, Human에서 1일 1회 50mg의 약효 용량을 기대한다면 (약 0.83mg/kg)로서 Rat에서는 약 ED50 < 5mg/kg, Mouse에서는 약 ED50 < 10mg/kg에서 유의적인 약효를 보여주어야 할 것이다.
흡수/분포/대사/배출 (ADME) 또는 약물대사/체내동태 (DM/PK) 항목에서는 경구 투여 소분자 화합물에서 통상적으로 적용되는 기준과 Target Engagement Ratio (TER) 을 통해서 약효 예측이 가능하게 하여 PK-PD 상관관계를 설명하고자 했고, 또한 충분한 약효 발현을 위하여 TER >5으로 설정하고 있다 (cf. 경쟁물질 PF-05089771의 TER 수치-3). 여기서 TER은 약물의 Unbound fraction이 중요하기 때문에, 혈장 단백결합율 (PPB)을 98% 이하로 설정하고 있다. 또한 Blood Nerve Barrier 투과 (Nerve c-fiber suppression) 지표를 포함하였는데, 이는 신경은 BNB로 둘러싸여 보호되어 있어서 약물이 BNB를 투과하지 못하면 약효가 미달하게 발현될 것이므로 활성-PK-PD 간에 상관관계 설명이 가능하도록 하고 있다. 실제 임상에서 다양한 약제들과 중복으로 처방되는 점을 감안하여, 약물 상호작용의 우려를 차단하기 위해서 IC50 대비 200배 이상의 CYPs 저해 안전역을 확보하고자 하였고, 향후 human에서 1일 1회 경구 투여가 가능하여야 하므로 설치류에서 생체이용율 (Bioavailability, BA) 30% 이상과 반감기 (t1/2) 3 hr 이상으로 하고 있다.
안전성 (Safety) 항목은 ① In vitro에서는 심장독성 (hERG), 유전독성 (Ames), Off-targets effects에 의한 부작용 가능성을 고려하였고, ② in vivo에서는 중추신경계 (CNS)에 대한 약물의 영향을 평가하기 위한 일반행동약리 (FOB)와 반복투여시 100배 이상의 충분한 안전역을 확보하도록 설정하였다.
다음으로는 항섬유화제 (Anti-fibrosis) 개발을 목표로 하고 있는 후보물질을 대상으로 Target Product (/Candidate) Profile로 설정했던 사례를 소개해 본다 <표 3>.
물리화학적 성질 (Physicochemical property) 항목에서는 소분자 화합물이면서 경구 투여를 목표로 하므로, 통상적으로 이들 약물에 적용되는 분자량, 적절한 범주의 지질도 (cLogP)와 물에 대한 일정 이상의 용해도를 감안하여 기준을 설정한 것을 볼 수 있다.
In vitro activity (활성) 항목에서는 주로 활성과 선택성으로서, 동일 타겟 저해제인 Halofuginone IC50 = 95 nM 수준이고 Off-targets 선택성이 낮는 점을 감안하였고, 특히 항섬유화 지표로 활용되는 Collagen inhibition을 반영하고 있다.
In vivo efficacy (약효) 항목에서는 Bleomycin-induced lung fibrosis model MED (mouse, PO, QD)에서는 동일 질환 승인 약물인 Nintedanib 대비 10배, Pirfenidone 대비 40배 낮은 저용량을 특장점으로 하고 있고, Mouse cardiac fibrosis (TAC) model ED50 (PO, QD, 2 Weeks)에서도 Pirfenidone 대비 40배 낮은 저용량을 기준으로 하고 있다.
약물대사/체내동태 (DM/PK) 항목에서는 경구 투여 소분자 화합물에 통상적으로 적용되는 기준과 섬유증의 특성상 고령환자에서 발생률이 높아 다양한 약물과 중복 처방이 되어 약물상호작용 우려를 차단하기 위해 IC50 대비 100배 이상의 CYPs 저해 안전역을 확보하고자 하였고, 향후 고령 환자의 복용 편의성을 위해서 1일 1회 경구 투여가 가능하여야 하므로 설치류에서 생체이용율 (Bioavailability, BA) 40% 이상과 반감기 (t1/2) 3 hr 이상으로 하고 있다.
안전성 (Safety) 항목은 ① In vitro에서는 심장독성 (hERG), 세포 독성 (Cytotoxicity), 유전독성 (Genotoxicity-Ames)에 대한 안전성을 고려하였고, ② in vivo에서는 설치류에서 NOAEL은 약효 용량보다 최소 > 10배, 비설치류에서 >6배일 경우 임상시험에서 안전함을 반영하고 있고, 동일 질환 승인 약물인 Nintedanib과 Pirfenidone 대비 10배 넓은 안전역을 확보하여 안전성을 부각하고 있다.
<표 3. 항섬유화제 후보물질 Target Product (/Candidate) Profile (TPP) 사례>
이상에서와 같이, 각 주요 항목에 해당하는 핵심 지표를 선별하고 이에 대한 평가 기준 (Criteria)을 설정하고 있는데, 제시하고 있는 기준은 과학적/임상적 근거, 경쟁력/차별화, 핵심 성공요인 (KSF) 등을 반영하여 설정하고 있는 것을 볼 수 있다. 특히 First-in-Class인 경우에는 새로운 치료 옵션을 제공하면서 타 기전 경쟁물질 대비 약효 및 안전성 측면에서 차별화 포인트를 가져갈 수 있도록 중점적으로 고려하고 있는 것을 볼 수 있다.
이후에는 연구개발 물질이 기 설정한 후보물질 Target Product (/Candidate) Profile (TPP)상에 있는 기준을 달성하는지를 평가하기 위한 Screening cascade (/flow)를 운용하게 된다. 여기 검색 평가 상에 있는 각 항목들은 프로젝트의 특성, 우선 순위와 중요도를 감안하여, 각 연구기관에서 활용 가능한 내·외부 연구자원을 모두 동원하여 최대한 단축된 기간에 Cycle이 진행될 수 있도록 배열하는 것이 필요하다.
3. 결론
의약품 연구개발 과정에서 Target Product Profile (TPP, 목표 제품 특성)은 ▲연구개발 기관 안팎에서 이해 당사자들 간의 소통 뿐 만이 아니라, ▲규제 기관 (정부 인허가)과의 소통을 원활히 하기 위한 수단 역할을 담당하고 있고, ▲이러한 TPP 항목의 상당부분은 종국적으로는 규제 기관의 인허가를 득하고 시장에 출시되는 제품 라벨 상에 서지 사항이 될 것이다.
여기서는 최종 목표 제품 특성 (Target Product/Clinical Profile-TPP)과 목표 후보물질 특성 (Target Product/Candidate Profile)의 중요성과 설정 방법에 대해서 각기 사례를 가지고 기술해 보았다. 프로젝트 리더 (Project Leader, PL)의 입장에서도 프로젝트가 선정된 이후에 연구개발 전 과정에서 최종 목표점 (Target Product Profile, TPP)을 참여 연구진들과 경영진 등 이해 당사자 모두가 함께 공유해 나가면서 한 방향으로 정렬하고 집중하게 할 필요가 있다. 또한 일단 한번 설정한 Target Product Profile은 제품의 출시 시점까지 결코 고정된 것이 아니라, 연구개발 과정에서 ▲중대한 시장의 변화, ▲유사 경쟁 물질의 출현, ▲개발 물질에서 특장점 발굴 등의 주요 사안 발생시에는 수정 보완이 필요하다 점도 유념했으면 한다.
[참고 자료]
The Target Product Profile as a tool for regulatory communication: advantageous but underused, Nature Reviews Drug Discovery, Volume 16, page 156 (2017)
Chapter 2. Target Product Profile (TPP) 설정의 중요성
1. 서론
의약품 개발에 있어서 Target Product Profile (TPP, 목표 제품 특성)은 연구개발 기관 안팎에서 이해 당사자들 간의 소통 뿐 만이 아니라, 규제 기관 (정부 인허가)과의 소통을 원활히 하기 위한 수단 역할을 담당하고 있다 [그림 1]. 즉, 연구기관 안팎에서는 TPP에 기재된 연구개발의 최종 목표점을 이해 당사자들 모두가 공유하면서 연구 방향성을 제시하게 되고, 규제 기관과는 최종 시장에 출시하는 제품의 라벨을 정하기 위한 일련의 연구개발 계획과 과정을 피드백 하고 있다는 점이다 <그림 1>. TPP 상에는 제품 사양, 작용기전, 안전성, 효능, 체내동태, 투여 경로 등과 관련된 항목들이 있으며, 세부적으로는 제품의 임상 적응증과 사용에 관한 여러 사항들이 포함되어 있는 것을 볼 수 있다.
<그림 1. Use and impact of Target Product Profile (TPP)>
특히, 국내의 많은 신약 프로젝트에서는 중개연구 (Translational Research) 차원에서 연구개발 후보물질에 대한 Target Product (/Candidate) Profiles 설정을 중요시하고 중점 관리하고 있는 실정이며, 더 나가서는 선도물질 (Lead Compound)에 대한 Target Product (/Lead) Profile까지도 설정하는 사례가 있다.
이와 같이, 의약품의 연구개발에 있어서 이해 당사자들 간에 중요한 소통 수단 역할을 담당하는 최종 목표 제품 특성 (Target Product/Clinical Profiles, TPP)과 목표 후보물질 특성 (Target Product/Candidate Profile)의 설정 방법과 중요성에 대해서 신약 연구개발에서 각기 사례를 들어서 기술해 보기로 한다.
2. 본론
의약품 연구개발 신규 프로젝트 발굴 및 선정 시점에서부터, 최종 제품에 대한 Target Product (/Clinical) Profile (TPP, 목표 제품 특성)과 개발 후보물질에 대한 Target Product (/Candidate) Profile 설정에 대해서 고려하는 것이 필요하다고 본다. 즉, 연구개발 기관에서 개발하고자 하는 최종 목표 제품이 무엇인지를 구체화시킬 필요가 있으며, 이러한 목표 달성을 위해서는 어느 정도의 수준과 특성을 보유한 후보물질이 요구되며, 이 후보물질을 가지고서 어떠한 방법과 전략으로 개발할 것인지에 대한 계획이 필요한 것이다. 물론, 신규 프로젝트 초기에 설정한 TPP는 연구개발 과정에서 시장 상황과 경쟁력 등을 반영하여 지속적으로 업데이트 할 필요가 있다. 최종 목표 제품의 TPP 설정을 위해서는 의학적 수요, (잠재적) 경쟁 제품, 제품 종류, 마켓 포지셔닝, 작용기전, 효능과 안전성, 임상 적응증과 사용, 투여 경로 등에 대한 고려가 필요하고, 이들 TPP 항목들의 상당부분은 종국적으로 규제 기관의 인허가를 득하고 시장에 출시되는 제품 라벨 상에 서지 사항이 될 것이다.
우선, 연구 초기에 프로젝트 리더 (Project Leader, PL) 관점에서 파킨슨 (Parkinson’s Disease) 치료제 개발을 목표로 Target Product (/Clinical) Profiles (TPP, 목표 제품 특성)을 설정했던 사례를 소개해 본다 <표 1>.
1. 제품 사양 (Product Descriptions) 항목은 New Chemical Entity (NCE)로서 신경보호 소분자 물질이며 작용 기전은 Anti-apoptosis로 표기되었다 (작용점 생략).
2. 적응증 (Indications) 항목은 본 제품의 주요 치료 대상 환자군에 대해서 정의했고, 여기에는 현재 임상에서 1차 치료제로 사용되고 있는 DOPA 약제에 대한 사용 조건을 포함하고 있다.
3. 유효성 (Efficacy) 항목에는 단독 또는 DOPA 약제와의 병용 투여를 통해서 개발 제품이 달성시키고자 하는 파킨슨 질환 환자들의 치료 수준과 목표에 대한 기대 효능을 기술하고 있다.
4. 안전성 (Safety) 항목에서는 개발하고자 하는 의약품이 파킨슨 (Parkinson’s Disease) 치료제인 관계로, 특히 중추신경계 (CNS) 약물에서 빈번하면서도 심각하게 간주되는 부작용에 관한 것과 DOPA 약제와의 병용 투여를 감안하여 이들간에 약물 상호 작용에 대한 우려를 불식시키고자 하고 있다.
5. 투여 (Dosage) 항목에서는 복약 편의성에 따른 시장매력도를 감안하여 투여 경로 (경구)와 투여 간격 (1회/1일)을 제시하고 있다.
이와 같이 TPP를 설정함으로써, 최종 TPP 항목 1~5를 충족시키기 위해서는 중개연구 (Translational Research)와 개발 측면에서 후보물질의 Target Product (/Candidate) Profile은 어떻게 설정되어야 하는지를 알 수 있게 될 것이다.
<표 1. 파킨슨 치료제 Target Product (/Clinical) Profile (TPP) 사례>
앞에서 국내의 많은 신약 연구개발 프로젝트에서는 개발 후보물질에 대해서 Target Product (/Candidate) Profile을 설정하고 중점 관리하고 있다고 언급한 바, 이는 그동안 연구개발 기관 대부분의 의약품 연구개발 프로젝트, 특히 많은 신약 프로젝트들이 탐색연구 과정에 있으며 이 과정을 죽음의 계곡 (Death Valley)으로 보는 시각에서 중개 연구 (Translational Research)를 중요시 하기 때문인 것으로 본다. 따라서 다음 순서에서는 연구개발 후보물질들을 대상으로 Target Product (/Candidate) Profile이 설정된 사례들을 살펴보기로 하자.
첫 번째로 신약 탐색연구 과정에서 프로젝트 리더 (Project Leader, PL) 관점에서 진통제 (Pain) 개발을 목표로 하고 있는 후보물질을 대상으로 Target Product (/Candidate) Profile로 설정했던 사례를 소개해 본다 <표 2>.
물리화학적 성질 (Physicochemical property)은 약물성 (Drug-likeness)에 해당하는 항목으로서 치료적 수요 (Therapeutic Needs)에 기반하여 목표로 하는 의약품의 제형이나 투여 경로에 따라서 적합한 기준을 설정하고 있다. 여기서는 소분자 화합물이면서 경구 투여를 목표로 하므로, 통상적으로 이들 약물에 적용되는 적절한 범주의 지질도 (cLogP)와 물에 대한 일정 이상의 용해도를 감안하여 기준을 설정한 것을 볼 수 있다.
작용 기전 (Mode of Action, MoA) 항목은 임상적 유효성 (Efficacy)과 안전성 (Safety)을 예측하는 자료로 매우 중요하게 활용된다. 여기서는 Nav1.7 이온채널 타겟에 대하여 정상 대비 질환 통증 상태에만 작용하도록 하기 위해서 State & Use dependency 억제 패턴을 가지는 작용 기전을 지향하고 있다. 이는 경쟁물질 CNV1014802가 삼차신경통 임상 2상에서 약효를 입증한 바 있고, CNV1014802는 State & Use dependency를 가지기 때문에 부작용 (Side effects)가 없는 것으로 보고하고 있고, 글로벌 제약사에서 개발중인 Nav1.7 blockers는 모두 State & Use dependency 물질임을 감안하고 있다.
<표 2. 진통제 후보물질 Target Product (/Candidate) Profile (TPP) 사례>
효능 (Efficacy) 항목에서 ① In vitro는 주로 활성 (Activity)과 선택성 (Selectivity)에 관한 것으로서, 경쟁물질 CNV1014802는 Nav1.7 IC50가 1~5uM수준이며 subtype selectivity가 10배 이하 임을 감안하였고, 특히 Nav1.5는 Cardiac muscle, Nav1.1, 1.2, 1.3은 중추신경계 (CNS)에 많이 분포하고 있으며, 현재 임상에서 사용되는 신경병성 통증 약물들 (Lamotrigine, Carbamazepine등)은 Subtypes selectivity가 없기 때문에 Dizziness, Mental disorder 등의 부작용이 발생한다는 점을 반영하고 있다. ② Ex vivo는 Human DRG에서의 IC50과 Action potential 100% block@1uM을 정하고 있는데, 이는 Human DRG에서의 우수한 활성을 후보물질의 특장점으로 제시하여 임상 연계 (translation) 가능성 높이고자 함이다. ③ In vivo는 Safety margin을 고려하여 ED50을 산정하고 있다. 시험 동물의 체표 면적 차이 (전환 비율, Conversion Factor)로 계산하였을 때, Human에서 1일 1회 50mg의 약효 용량을 기대한다면 (약 0.83mg/kg)로서 Rat에서는 약 ED50 < 5mg/kg, Mouse에서는 약 ED50 < 10mg/kg에서 유의적인 약효를 보여주어야 할 것이다.
흡수/분포/대사/배출 (ADME) 또는 약물대사/체내동태 (DM/PK) 항목에서는 경구 투여 소분자 화합물에서 통상적으로 적용되는 기준과 Target Engagement Ratio (TER) 을 통해서 약효 예측이 가능하게 하여 PK-PD 상관관계를 설명하고자 했고, 또한 충분한 약효 발현을 위하여 TER >5으로 설정하고 있다 (cf. 경쟁물질 PF-05089771의 TER 수치-3). 여기서 TER은 약물의 Unbound fraction이 중요하기 때문에, 혈장 단백결합율 (PPB)을 98% 이하로 설정하고 있다. 또한 Blood Nerve Barrier 투과 (Nerve c-fiber suppression) 지표를 포함하였는데, 이는 신경은 BNB로 둘러싸여 보호되어 있어서 약물이 BNB를 투과하지 못하면 약효가 미달하게 발현될 것이므로 활성-PK-PD 간에 상관관계 설명이 가능하도록 하고 있다. 실제 임상에서 다양한 약제들과 중복으로 처방되는 점을 감안하여, 약물 상호작용의 우려를 차단하기 위해서 IC50 대비 200배 이상의 CYPs 저해 안전역을 확보하고자 하였고, 향후 human에서 1일 1회 경구 투여가 가능하여야 하므로 설치류에서 생체이용율 (Bioavailability, BA) 30% 이상과 반감기 (t1/2) 3 hr 이상으로 하고 있다.
안전성 (Safety) 항목은 ① In vitro에서는 심장독성 (hERG), 유전독성 (Ames), Off-targets effects에 의한 부작용 가능성을 고려하였고, ② in vivo에서는 중추신경계 (CNS)에 대한 약물의 영향을 평가하기 위한 일반행동약리 (FOB)와 반복투여시 100배 이상의 충분한 안전역을 확보하도록 설정하였다.
다음으로는 항섬유화제 (Anti-fibrosis) 개발을 목표로 하고 있는 후보물질을 대상으로 Target Product (/Candidate) Profile로 설정했던 사례를 소개해 본다 <표 3>.
물리화학적 성질 (Physicochemical property) 항목에서는 소분자 화합물이면서 경구 투여를 목표로 하므로, 통상적으로 이들 약물에 적용되는 분자량, 적절한 범주의 지질도 (cLogP)와 물에 대한 일정 이상의 용해도를 감안하여 기준을 설정한 것을 볼 수 있다.
In vitro activity (활성) 항목에서는 주로 활성과 선택성으로서, 동일 타겟 저해제인 Halofuginone IC50 = 95 nM 수준이고 Off-targets 선택성이 낮는 점을 감안하였고, 특히 항섬유화 지표로 활용되는 Collagen inhibition을 반영하고 있다.
In vivo efficacy (약효) 항목에서는 Bleomycin-induced lung fibrosis model MED (mouse, PO, QD)에서는 동일 질환 승인 약물인 Nintedanib 대비 10배, Pirfenidone 대비 40배 낮은 저용량을 특장점으로 하고 있고, Mouse cardiac fibrosis (TAC) model ED50 (PO, QD, 2 Weeks)에서도 Pirfenidone 대비 40배 낮은 저용량을 기준으로 하고 있다.
약물대사/체내동태 (DM/PK) 항목에서는 경구 투여 소분자 화합물에 통상적으로 적용되는 기준과 섬유증의 특성상 고령환자에서 발생률이 높아 다양한 약물과 중복 처방이 되어 약물상호작용 우려를 차단하기 위해 IC50 대비 100배 이상의 CYPs 저해 안전역을 확보하고자 하였고, 향후 고령 환자의 복용 편의성을 위해서 1일 1회 경구 투여가 가능하여야 하므로 설치류에서 생체이용율 (Bioavailability, BA) 40% 이상과 반감기 (t1/2) 3 hr 이상으로 하고 있다.
안전성 (Safety) 항목은 ① In vitro에서는 심장독성 (hERG), 세포 독성 (Cytotoxicity), 유전독성 (Genotoxicity-Ames)에 대한 안전성을 고려하였고, ② in vivo에서는 설치류에서 NOAEL은 약효 용량보다 최소 > 10배, 비설치류에서 >6배일 경우 임상시험에서 안전함을 반영하고 있고, 동일 질환 승인 약물인 Nintedanib과 Pirfenidone 대비 10배 넓은 안전역을 확보하여 안전성을 부각하고 있다.
<표 3. 항섬유화제 후보물질 Target Product (/Candidate) Profile (TPP) 사례>
이상에서와 같이, 각 주요 항목에 해당하는 핵심 지표를 선별하고 이에 대한 평가 기준 (Criteria)을 설정하고 있는데, 제시하고 있는 기준은 과학적/임상적 근거, 경쟁력/차별화, 핵심 성공요인 (KSF) 등을 반영하여 설정하고 있는 것을 볼 수 있다. 특히 First-in-Class인 경우에는 새로운 치료 옵션을 제공하면서 타 기전 경쟁물질 대비 약효 및 안전성 측면에서 차별화 포인트를 가져갈 수 있도록 중점적으로 고려하고 있는 것을 볼 수 있다.
이후에는 연구개발 물질이 기 설정한 후보물질 Target Product (/Candidate) Profile (TPP)상에 있는 기준을 달성하는지를 평가하기 위한 Screening cascade (/flow)를 운용하게 된다. 여기 검색 평가 상에 있는 각 항목들은 프로젝트의 특성, 우선 순위와 중요도를 감안하여, 각 연구기관에서 활용 가능한 내·외부 연구자원을 모두 동원하여 최대한 단축된 기간에 Cycle이 진행될 수 있도록 배열하는 것이 필요하다.
3. 결론
의약품 연구개발 과정에서 Target Product Profile (TPP, 목표 제품 특성)은 ▲연구개발 기관 안팎에서 이해 당사자들 간의 소통 뿐 만이 아니라, ▲규제 기관 (정부 인허가)과의 소통을 원활히 하기 위한 수단 역할을 담당하고 있고, ▲이러한 TPP 항목의 상당부분은 종국적으로는 규제 기관의 인허가를 득하고 시장에 출시되는 제품 라벨 상에 서지 사항이 될 것이다.
여기서는 최종 목표 제품 특성 (Target Product/Clinical Profile-TPP)과 목표 후보물질 특성 (Target Product/Candidate Profile)의 중요성과 설정 방법에 대해서 각기 사례를 가지고 기술해 보았다. 프로젝트 리더 (Project Leader, PL)의 입장에서도 프로젝트가 선정된 이후에 연구개발 전 과정에서 최종 목표점 (Target Product Profile, TPP)을 참여 연구진들과 경영진 등 이해 당사자 모두가 함께 공유해 나가면서 한 방향으로 정렬하고 집중하게 할 필요가 있다. 또한 일단 한번 설정한 Target Product Profile은 제품의 출시 시점까지 결코 고정된 것이 아니라, 연구개발 과정에서 ▲중대한 시장의 변화, ▲유사 경쟁 물질의 출현, ▲개발 물질에서 특장점 발굴 등의 주요 사안 발생시에는 수정 보완이 필요하다 점도 유념했으면 한다.
[참고 자료]
The Target Product Profile as a tool for regulatory communication: advantageous but underused, Nature Reviews Drug Discovery, Volume 16, page 156 (2017)